A química dos peptídeos |
Os peptídeos são compostos formados por
aminoácidos unidos entre si por ligações covalentes (amídicas ou
peptídicas). Eles podem ser imaginados como “os irmãos menores das
proteínas”, já que contêm muito menos aminoácidos do que elas. Por outro
lado, os peptídeos apresentam uma maior diversidade de modificações
químicas do que as “suas irmãs maiores”.
O interesse em estudar os peptídeos cresceu significativamente a partir das constatações iniciais de que eles são compostos químicos com funções essenciais à vida. Sem dúvida, no nosso organismo eles atuam como hormônios (ocitocina), fatores liberadores de hormônios (fator liberador da corticotropina), analgésicos (metionina-encefalina), antibióticos (histatina-5) e neurotransmissores (colecistocininas). Os outros seres vivos (variando de bactérias a mamíferos e plantas) também produzem este tipo de polímero biologicamente ativo, como as toxinas dos venenos, por exemplo.
A grande maioria dos estudos científicos realizados com os peptídeos tem como objetivos finais:
(i) o seu uso terapêutico em mamíferos (para tratar distúrbios hormonais e infecções microbianas, por exemplo);
(ii) a determinação das suas propriedades, das suas funções e dos mecanismos moleculares pelos quais eles exercem as suas funções;
(iii) a preparação de compostos químicos derivados dos peptídeos encontrados na natureza (chamados de “peptídeos originais”) ou a síntese de novos peptídeos.
Estes novos peptídeos podem ter capacidade de: a) ativar ou inibir os processos biológicos dos quais os peptídeos originais participam (por exemplo, o peptídeo deamino-l-carba-ocitocina, derivado do hormônio ocitocina, também estimula contrações uterinas em fêmeas de mamíferos); b) atuar como vacinas (por exemplo, a penetratina); c) funcionar como materiais biodegradáveis com diversas utilidades (por exemplo, nanotubos e nanofios de peptídeos). Para que todos estes estudos pudessem ser realizados, químicos, bioquímicos, físicos, biólogos e médicos se dedicaram a conceber e aprimorar métodos, procedimentos e protocolos para a detecção, dosagem, isolamento das fontes naturais, purificação, determinação de estrutura química, síntese e análise de peptídeos. Este tipo de atividade passou a ser denominada de Química de Peptídeos.
No mundo inteiro, a síntese de peptídeos foi e continua a ser alvo de intensa pesquisa, pois os métodos existentes para tal foram e continuam a ser empregados em laboratórios científicos e em empresas internacionais que preparam peptídeos em micro- e macro-escalas. De fato, nas fontes naturais os peptídeos geralmente exercem as suas funções em quantidades muito reduzidas e, portanto, a síntese laboratorial evita a depredação do ambiente (sacrifício de muitos animais e plantas) e permite a obtenção de quantidades de peptídeos suficientes para uso terapêutico e realização de estudos científicos.
Hoje, todas as modalidades de síntese de peptídeos se enquadram em um dos seguintes tipos:
a) síntese usando DNA recombinante, que utiliza todas as técnicas modernas de expressão gênica e clonagem celular para fornecer o peptídeo original e seus mutantes. Geralmente, as bactérias clonadas são utilizadas como “ fábricas de produção” destes compostos. Por isso, este tipo de síntese tem ficado mais restrito à produção de peptídeos formados apenas por aminoácidos usuais e sem modificações químicas.
b) síntese biocatalisada, na qual enzimas proteolíticas (que catalisam a quebra das ligações peptídicas in vivo) são colocadas em condições reacionais específicas que as fazem trabalhar no sentido contrário (de síntese destas ligações) in vitro. Este método entrou para a classe de “tecnologias químicas limpas” ou “química auto-sustentável” ou “química verde”, pois permite a produção de peptídeos sintéticos de melhor qualidade com redução de resíduos tóxicos no ambiente. Por outro lado, o método também tem se limitado à produção de peptídeos formados apenas por aminoácidos usuais. Além disso, este método continua a ser estudado porque não existe uma enzima proteolítica universal capaz de catalisar a formação de todas as ligações peptídicas existentes em um peptídeo sem também catalisar a quebra daquelas já formadas.
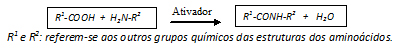
c) síntese química de peptídeos, que se baseia no uso de um composto químico (ativador) que reage com o grupo carboxila (-COOH) de um aminoácido e o torna mais reativo ao grupo amina (H2N-) do outro aminoácido, resultando na liberação de água e formação da ligação peptídica entre eles (R1-CONH-R2):
O interesse em estudar os peptídeos cresceu significativamente a partir das constatações iniciais de que eles são compostos químicos com funções essenciais à vida. Sem dúvida, no nosso organismo eles atuam como hormônios (ocitocina), fatores liberadores de hormônios (fator liberador da corticotropina), analgésicos (metionina-encefalina), antibióticos (histatina-5) e neurotransmissores (colecistocininas). Os outros seres vivos (variando de bactérias a mamíferos e plantas) também produzem este tipo de polímero biologicamente ativo, como as toxinas dos venenos, por exemplo.
A grande maioria dos estudos científicos realizados com os peptídeos tem como objetivos finais:
(i) o seu uso terapêutico em mamíferos (para tratar distúrbios hormonais e infecções microbianas, por exemplo);
(ii) a determinação das suas propriedades, das suas funções e dos mecanismos moleculares pelos quais eles exercem as suas funções;
(iii) a preparação de compostos químicos derivados dos peptídeos encontrados na natureza (chamados de “peptídeos originais”) ou a síntese de novos peptídeos.
Estes novos peptídeos podem ter capacidade de: a) ativar ou inibir os processos biológicos dos quais os peptídeos originais participam (por exemplo, o peptídeo deamino-l-carba-ocitocina, derivado do hormônio ocitocina, também estimula contrações uterinas em fêmeas de mamíferos); b) atuar como vacinas (por exemplo, a penetratina); c) funcionar como materiais biodegradáveis com diversas utilidades (por exemplo, nanotubos e nanofios de peptídeos). Para que todos estes estudos pudessem ser realizados, químicos, bioquímicos, físicos, biólogos e médicos se dedicaram a conceber e aprimorar métodos, procedimentos e protocolos para a detecção, dosagem, isolamento das fontes naturais, purificação, determinação de estrutura química, síntese e análise de peptídeos. Este tipo de atividade passou a ser denominada de Química de Peptídeos.
No mundo inteiro, a síntese de peptídeos foi e continua a ser alvo de intensa pesquisa, pois os métodos existentes para tal foram e continuam a ser empregados em laboratórios científicos e em empresas internacionais que preparam peptídeos em micro- e macro-escalas. De fato, nas fontes naturais os peptídeos geralmente exercem as suas funções em quantidades muito reduzidas e, portanto, a síntese laboratorial evita a depredação do ambiente (sacrifício de muitos animais e plantas) e permite a obtenção de quantidades de peptídeos suficientes para uso terapêutico e realização de estudos científicos.
Hoje, todas as modalidades de síntese de peptídeos se enquadram em um dos seguintes tipos:
a) síntese usando DNA recombinante, que utiliza todas as técnicas modernas de expressão gênica e clonagem celular para fornecer o peptídeo original e seus mutantes. Geralmente, as bactérias clonadas são utilizadas como “ fábricas de produção” destes compostos. Por isso, este tipo de síntese tem ficado mais restrito à produção de peptídeos formados apenas por aminoácidos usuais e sem modificações químicas.
b) síntese biocatalisada, na qual enzimas proteolíticas (que catalisam a quebra das ligações peptídicas in vivo) são colocadas em condições reacionais específicas que as fazem trabalhar no sentido contrário (de síntese destas ligações) in vitro. Este método entrou para a classe de “tecnologias químicas limpas” ou “química auto-sustentável” ou “química verde”, pois permite a produção de peptídeos sintéticos de melhor qualidade com redução de resíduos tóxicos no ambiente. Por outro lado, o método também tem se limitado à produção de peptídeos formados apenas por aminoácidos usuais. Além disso, este método continua a ser estudado porque não existe uma enzima proteolítica universal capaz de catalisar a formação de todas as ligações peptídicas existentes em um peptídeo sem também catalisar a quebra daquelas já formadas.
c) síntese química de peptídeos, que se baseia no uso de um composto químico (ativador) que reage com o grupo carboxila (-COOH) de um aminoácido e o torna mais reativo ao grupo amina (H2N-) do outro aminoácido, resultando na liberação de água e formação da ligação peptídica entre eles (R1-CONH-R2):
Inicialmente, as sínteses químicas eram
realizadas com todos os reagentes dissolvidos em solventes orgânicos.
Os produtos obtidos também ficavam dissolvidos, o que tornava a síntese
trabalhosa e demorada devido à necessidade e dificuldade de separar os
peptídeos obtidos dos reagentes que eram empregados para gerá-lo. Ávido
por agilização do processo sintético, em 1963, Robert Bruce Merrifield -
Prêmio Nobel de Química de 1984- descreveu o método da fase sólida
(SPFS), que se baseia na ligação sequencial dos aminoácidos que formam o
peptídeo a um polímero orgânico insolúvel em qualquer solvente. Assim, o
processo de síntese foi mesmo agilizado, pois o peptídeo que cresce
ligado ao polímero pode ser separado dos reagentes por simples
filtração.
A Figura 1 é uma
representação esquemática das moléculas de um peptídeo ligadas ao
polímero orgânico durante este tipo de síntese. Este método é o mais
geral e mais empregado para a obtenção de peptídeos sintéticos contendo
aminoácidos usuais e não usuais, sem e com modificações químicas, devido
principalmente à sua praticidade, rapidez e possibilidade de
automatização. O método da fase sólida possibilita a síntese individual
(de um peptídeo por vez), a síntese múltipla (de vários a dezenas de
peptídeos ao mesmo tempo), a geração de bibliotecas (síntese simultânea
de centenas a milhares de peptídeos) e a construção de micro-arranjos
(síntese de peptídeos diferentes em posições específicas de uma placa
sólida), podendo ser realizada à temperatura ambiente ou em temperaturas
mais elevadas (no nosso laboratório usamos 60C e as micro-ondas). Ao
final do processo sintético, o peptídeo é “desligado” do polímero.
Apesar do avanço alcançado, entretanto, este tipo de síntese ainda
continua sendo investigado, pois ele emprega grandes quantidades de
solventes orgânicos, pode gerar resíduos nocivos ao ambiente e causa
reações químicas indesejadas que podem comprometer a qualidade do
peptídeo obtido.
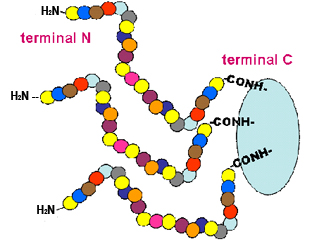
Figura 1. Representação esquemática das moléculas de um peptídeo
(formado pelos aminoácidos indicados por bolinhas coloridas; cada cor é um tipo de aminoácido) que está sendo sintetizado sobre uma fase sólida (polímero orgânico aqui representado pelo círculo azul). O crescimento da cadeia se dá na direção terminal C terminal N.
O peptídeo sintético obtido por qualquer um dos três métodos citados deve ser analisado por técnicas químicas sofisticadas para avaliação da sua qualidade. Ele é submetido a um processo de purificação que remove as possíveis impurezas (subprodutos formados durante a síntese). Uma vez purificado, o peptídeo sintético tem o seu grau de pureza novamente avaliado e a sua estrutura química confirmada. Só então, ele pode ser usado com segurança em estudos científicos, para fins industriais e, principalmente, terapêuticos.
A Química de Peptídeos, portanto, foi, é e continuará a ser uma área da Química e da Bioquímica de intensa atividade, bem como de grande relevância científica e prática. Ela trouxe e ainda trará inúmeros benefícios para a humanidade.
Quadro de conceitos
Aminoácidos: compostos formados por 4 diferentes grupos químicos ligados a um carbono, ou seja, um grupo amina NH2, um grupo carboxila COOH (daí o nome aminoácido), um hidrogênio e um grupo geralmente chamado de R [(CH2-OH, CH(CH3)2, CH3,-CH2-COOH, por exemplo)]. O que difere um aminoácido do outro é o grupo R.
Sequência de aminoácidos: os peptídeos diferem entre si no número (geralmente menor do que 50) e sequência de aminoácidos que os compõem. Exemplo: colecistocinina-8, que tem funções hormonal e neurotransmissora, contém 8 aminoácidos, é amidado (-CONH2) na fenil-alanina (Phe) terminal e sulfatado (-SO3H) no grupo R da tirosina (Tyr) (Figura 2).
(formado pelos aminoácidos indicados por bolinhas coloridas; cada cor é um tipo de aminoácido) que está sendo sintetizado sobre uma fase sólida (polímero orgânico aqui representado pelo círculo azul). O crescimento da cadeia se dá na direção terminal C terminal N.
O peptídeo sintético obtido por qualquer um dos três métodos citados deve ser analisado por técnicas químicas sofisticadas para avaliação da sua qualidade. Ele é submetido a um processo de purificação que remove as possíveis impurezas (subprodutos formados durante a síntese). Uma vez purificado, o peptídeo sintético tem o seu grau de pureza novamente avaliado e a sua estrutura química confirmada. Só então, ele pode ser usado com segurança em estudos científicos, para fins industriais e, principalmente, terapêuticos.
A Química de Peptídeos, portanto, foi, é e continuará a ser uma área da Química e da Bioquímica de intensa atividade, bem como de grande relevância científica e prática. Ela trouxe e ainda trará inúmeros benefícios para a humanidade.
Quadro de conceitos
Aminoácidos: compostos formados por 4 diferentes grupos químicos ligados a um carbono, ou seja, um grupo amina NH2, um grupo carboxila COOH (daí o nome aminoácido), um hidrogênio e um grupo geralmente chamado de R [(CH2-OH, CH(CH3)2, CH3,-CH2-COOH, por exemplo)]. O que difere um aminoácido do outro é o grupo R.
Sequência de aminoácidos: os peptídeos diferem entre si no número (geralmente menor do que 50) e sequência de aminoácidos que os compõem. Exemplo: colecistocinina-8, que tem funções hormonal e neurotransmissora, contém 8 aminoácidos, é amidado (-CONH2) na fenil-alanina (Phe) terminal e sulfatado (-SO3H) no grupo R da tirosina (Tyr) (Figura 2).
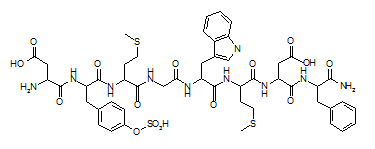
Asp ---- Tyr(SO3H)--Met-Gly ------Trp -----Met----Asp ---- Phe-NH2
Figura 2. Sequência de aminoácidos da colecistocinina-8 (usando o código de três letras para designar cada aminoácido)
Proteínas: estruturas químicas idênticas às dos peptídeos, porém com maior número de aminoácidos. As proteínas podem ser formadas por uma ou mais cadeias polipeptídicas. Elas, portanto, são consideradas como polímeros de aminoácidos de alta massa molar. Exemplo: lisozima (cada uma das bolinhas azuis representa um aminoácido) (Figura 3).

Figura 3. Lisozima (extraída de http://textbookofbacteriology.net/themicrobialworld/chemoc.html)
Síntese: processo que compreende uma ou mais reações entre compostos químicos para produzir um ou mais produtos.
Aminoácidos usuais: são aqueles que formam os peptídeos e as proteínas da maioria dos animais e plantas. No homem eles são obtidos da dieta (os essenciais) ou são biossintetizados (os não essenciais). Algumas bactérias e fungos produzem aminoácidos com propriedades químicas e físicas diferentes, os chamados “aminoácidos não usuais”.
Enzima: proteína capaz de aumentar a velocidade de uma ou mais reações químicas. As enzimas são os catalisadores das reações que ocorrem nas células animais e vegetais. Elas também tornam essas reações seletivas e quantitativas.
Polímero orgânico: composto químico de natureza orgânica formado por repetições de uma unidade ou bloco construtivo (estrutura que se repete n vezes). O poliestireno, cujo bloco construtivo é o estireno (A), e a poliamida (B) são exemplos bastante conhecidos.
Síntese: processo que compreende uma ou mais reações entre compostos químicos para produzir um ou mais produtos.
Aminoácidos usuais: são aqueles que formam os peptídeos e as proteínas da maioria dos animais e plantas. No homem eles são obtidos da dieta (os essenciais) ou são biossintetizados (os não essenciais). Algumas bactérias e fungos produzem aminoácidos com propriedades químicas e físicas diferentes, os chamados “aminoácidos não usuais”.
Enzima: proteína capaz de aumentar a velocidade de uma ou mais reações químicas. As enzimas são os catalisadores das reações que ocorrem nas células animais e vegetais. Elas também tornam essas reações seletivas e quantitativas.
Polímero orgânico: composto químico de natureza orgânica formado por repetições de uma unidade ou bloco construtivo (estrutura que se repete n vezes). O poliestireno, cujo bloco construtivo é o estireno (A), e a poliamida (B) são exemplos bastante conhecidos.
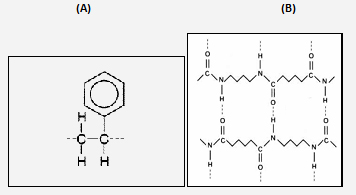
Representações estruturais extraídas de:
(A) http://www.americanchemistry.com/hops/intro_to_plastics/teachers.html
(B) http://commons.wikimedia.org/wiki/File:Structure_polyamide_4-6.png
Leia mais
http://www2.iq.usp.br/docente/?id=mtmirand
http://www.iq.usp.br/wwwdocentes/mtmirand/
Machado, A, Liria, CW, Proti, PB, Remuzgo, C & Miranda, MTM. Quim. Nova, 27(5), 781-789, 2004
Loffredo, C. & Miranda, MTM. (2005) Um marco na bioquímica e na medicina, Ciência Hoje, 36(214), 75-77.
Remuzgo, C; Andrade, GFS; Temperini, MLA & Miranda, MTM. Biopolym. – Pept. Sci., 92, 65-75, 2009.
Profª. Drª. M. Terêsa Machini Miranda
Laboratório de Química de Peptídeos, Departamento de Bioquímica
Instituto de Química, Universidade de São Paulo
mtmirand@iq.usp.br (Fonte: CRQ/IV)

Nenhum comentário:
Postar um comentário