Tautomeria
A tautomeria é um tipo de isomeria constitucional dinâmica em que os isômeros coexistem em um equilíbrio dinâmico.

A tautomeria sempre ocorre em equilíbrios dinâmicos na fase líquida
Isso ocorre sempre em sistemas líquidos, e os principais exemplos de tautomeria ocorrem comenóis, aldeídos e cetonas, como será mostrado mais adiante neste texto. Essa isomeria ocorre com esses compostos porque eles possuem um elemento muito eletronegativo (o oxigênio) ligado a um carbono insaturado, isto é, que faz uma dupla ligação. Desse modo, o oxigênio atrai fortemente os elétrons da dupla ligação, que é fraca e fácil de se deslocar, e um isômero transforma-se no outro.
Veja um exemplo abaixo de um equilíbrio aldoenólico, isto é, entre um aldeído e um enol, que possuem a mesma fórmula molecular C2H4O:
Etanal Etenol
O OH
║ │
H3C — C — H ↔ H2C ═ C — H
aldeído enol
Esse equilíbrio existe quando uma solução de aldeído acético (etanal) é preparada, sendo que uma pequena parte se transforma em etenol, que, por sua vez, regenera-se novamente em aldeído, estabelecendo o equilíbrio dinâmico.O OH
║ │
H3C — C — H ↔ H2C ═ C — H
aldeído enol
Observe que a diferença entre esses isômeros está no grupo funcional, assim, a tautomeria é um caso particular de isomeria plana de função.
Veja outro exemplo de tautomeria aldoenólica, em que temos no equilíbrio o propanal (aldeído) e o propenol (enol), cujas fórmulas moleculares são: C3H6O. Note que o átomo de hidrogênio do carbono vizinho migra para o oxigênio da carbonila:
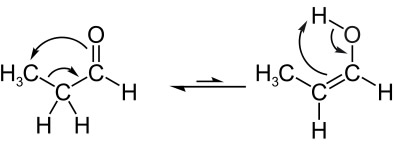
Prop-1-en-2-ol Propanona
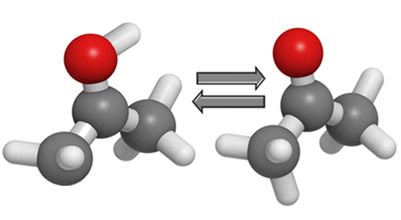
OH O
│ ║
H2C ═ C — CH3 ↔ H3C — C — CH3
ENOL CETONA
OH O
│ ║
H2C ═ C — CH3 ↔ H3C — C — CH3
ENOL CETONA
Por Jennifer Rocha Vargas Fogaça
Nenhum comentário:
Postar um comentário