Obtenção de halogênios por eletrólise
Os halogênios podem ser obtidos industrialmente por meio de processos de eletrólise.

Em condições ambientes, o flúor é um gás amarelo, o bromo é um líquido vermelho e o iodo é um sólido violeta*
É bem conhecido que a metalurgia
utiliza técnicas de eletrólise (passagem de eletricidade por um
composto no estado líquido a fim de decompô-lo) para a obtenção de
metais a partir de seus minérios.
No entanto, a eletrólise também é
utilizada para a obtenção de muitos ametais. Entre eles estão os
halogênios, que são os elementos pertencentes à família 17 (ou VII A) da
Tabela Periódica.
Entre eles, o mais importante comercialmente é o cloro, que em condições ambientes forma um gás (Cl2)
amarelo-esverdeado, denso, altamente tóxico e reativo, pouco solúvel em
água e que reage explosivamente com o hidrogênio. É usado na produção
de compostos orgânicos, inorgânicos, na fabricação de papel (visando ao
branqueamento de celulose) e no tratamento de águas e esgotos. O “cloro
líquido” é o cloro dissolvido em água, e o “cloro sólido” é, na verdade,
o sal hipoclorito de cálcio (Ca (ClO)2) e o sal hipoclorito de sódio (NaClO).
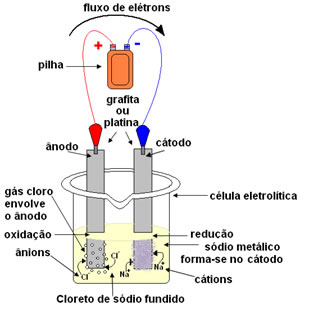
Uma das formas mais comuns de obtenção
do gás cloro é por meio da eletrólise ígnea do cloreto de sódio, ou
seja, funde-se o sal de cozinha, e é passada uma corrente elétrica por
esse sal no estado líquido, formando-se não só o gás cloro, mas também o
sódio metálico.
A reação global que ocorre nesse caso é dada por:
Cátodo: Na+(ℓ) + e- → Na(s)
Ânodo: 2Cl-(ℓ) → 2 e- + 1Cl2(g)____________
Reação Global: Na+(ℓ) + 2Cl-(ℓ) → Na(s) + 1Cl2(g)
Ânodo: 2Cl-(ℓ) → 2 e- + 1Cl2(g)____________
Reação Global: Na+(ℓ) + 2Cl-(ℓ) → Na(s) + 1Cl2(g)
A eletrólise do cloreto de magnésio (MgCl2) também é um meio de obtenção do gás cloro.
O flúor, ou melhor, o gás flúor (F2),
também pode ser obtido por meio de eletrólise, mas agora é do ácido
fluorídrico líquido (HF) na presença do fluoreto de potássio fundido
(KF).
As semirreações e a reação global dessa eletrólise são:
Cátodo: 2 H+ + 2e- → H2(g)
Ânodo: 2F- → 2 e- + F2(g)____________
Reação Global: 2 HF(ℓ) → H2(g)+ F2(g)
Ânodo: 2F- → 2 e- + F2(g)____________
Reação Global: 2 HF(ℓ) → H2(g)+ F2(g)
O cloro, o bromo e o iodo também podem ser obtidos por meio de reações de oxidorredução, como as mostradas a seguir:
Obtenção do bromo: Cl2(g)+ 2 NaBr(aq) → 2 NaCl(aq)+ 2 Br2(g)
Obtenção do iodo: Cl2(g)+ 2 NaI(aq) → 2 NaCl(aq)+ 2 I2(g)
O cloro gasoso é usado nas reações acima porque ele apresenta maior potencial de redução.
* Crédito editorial da imagem:
Fontes: Science Made Alive: Chemistry/Elem - Halogens/ Wikimedia Commons
Autor: W. Oelen
Autor: W. Oelen
Por Jennifer Rocha Vargas Fogaça
Nenhum comentário:
Postar um comentário